 |
|
 |

Радиационно-генетические исследования
Исследования вопросов генетического действия ускоренных тяжелых ионов проводятся в следующих основных направлениях: изучение закономерностей и механизмов образования и репарации повреждений ДНК в клетках человека, исследование вопросов действия ускоренных тяжелых ионов на хромосомный аппарат клеток человека, мутагенное действие излучений широкого диапазона ЛПЭ на клетки различных организмов, математическое моделирование индуцированного мутационного процесса у клеток прокариот.
-
Исследования закономерностей и механизмов образования и репарации двунитевых разрывов (ДР) ДНК в клетках человека проводятся на лимфоцитах периферической крови человека с использованием современных методов. Двунитевые разрывы ДНК, как известно, относятся к наиболее тяжелым повреждениям генома. Они являются молекулярным субстратом формирования различного вида структурных мутаций генов, аберраций хромосом, участвуют в инициации клеточной трансформации. ДР образуются при действии ионизирующих излучений, различных химических мутагенов и канцерогенов. Для определения закономерностей индукции и репарации ДР ДНК при действии ионизирующих излучений с разными физическими характеристиками используются методы ДНК-комет и ДНК-фокусов. Метод «ДНК-комет», основан на электрофорезе ДНК индивидуальных клеток в постоянном электрическом поле. При использовании этого метода геном отдельных клеток во флуоресцентном микроскопе представляется в виде электрофоретического следа. Длина следа и доля в нём ДНК связаны с поврежденностью клеточной ДНК. Метод ДНК-фокусов основан на использовании меченных флуоресцентными красителями отдельных ферментов, участвующих в репарации ДР ДНК. При использовании конфокального лазерного микроскопа можно регистрировать отдельные места – «фокусы» связывания этих ферментов с сайтами репарации образующихся ДР ДНК. С использованием этих методов проводится изучение закономерностей формирования и репарации ДР ДНК в широком диапазоне ЛПЭ излучений. При этом применяются различные радиомодификаторы для выявления скрытых потенциальных повреждений генетических структур.
 |
| ДНК-кометы при облучении лимфоцитов человека γ-лучами и ускоренными ионами 7Li (40 MэВ/нуклон) |
|
|
Продолжается изучение индукции хромосомных повреждений малыми дозами излучения с разной ЛПЭ в лимфоцитах периферической крови человека. Многочисленные данные, полученные ранее тремя цитогенетическими методами (метафазный, анафазный метод, микроядерный тест) на лимфоцитах периферической крови различных доноров с использованием различного дизайна эксперимента (облучение изолированных лимфоцитов или цельной крови) и излучений разного качества (γ-, рентгеновское излучение, ускоренные ионы углерода с энергией 100 и 400 МэВ/нуклон) показывают гиперчувствительность (ГЧ) клеток при дозах 1-5 сГр. С ростом дозы наблюдается увеличение радиорезистентности и снижение числа аберраций практически до контрольного уровня. При дозах свыше 50-70 сГр зависимость доза-эффект приобретает линейный характер. Метафазный анализ выявил, что ГЧ обусловлена в основном индукцией хроматидных аберраций, которые характерны главным образом для спонтанно-индуцированных нарушений и по классическим представлениям не индуцируются ионизирующим излучением. Однако в последние годы накоплено большое количество данных, свидетельствующих о важной роли радиационно-индуцированной генерации активных форм кислорода (АФК) всех феноменах малых доз, включая генетическую нестабильность и bystander-эффект. На цитогенетическом уровне действие АФК регистрируется как индукция аберраций хроматидного типа. В дальнейших исследованиях планируется проверить гипотезу, что возрастание АФК после облучения малыми дозами может лежать в основе ГЧ клеток, тогда как последующее снижение радиочувствительности является результатом активации защитных сигнальных систем клетки. Разрабатываются экспериментальные подходы к исследованию механизмов, лежащих в основе гиперчувствительности и индуцированной радиорезистентности. Для этого используется серия ингибиторов генерации АФК, которые, по всей видимости, играют важную роль в гиперчувствительности клеток к радиации, наблюдаемой в области 2-5 сГр, ингибиторы EGRF – рецепторов эпителиального ростового фактора, который участвует в передаче сигнала в клетке, а также серию ингибиторов и активаторов митоген-активируемой протеинкиназы раннего клеточного ответа ERK, которая известна как ранний и очень чувствительный цитопротекторный механизм и может быть ответственна за возрастание радиорезистентности, следующее за пиком ГЧ. Цитогенетический анализ проводится на клетках карциномы человека Cal 5, которая характеризуется нормальным диплоидным набором хромосом, и в последствии на лимфоцитах крови человека. Исследуется индивидуальная радиочувствительность клеток человека. Проведена серия экспериментов по исследованию индивидуальных отклонений распределения повреждений ДНК в хромосомах - 2, 8, 14 (лимфоциты периферической крови человека) в зависимости от ЛПЭ излучений. Результаты экспериментов показывают, что междонорные отличия могут быть причиной ошибки в биодозиметрии при определении полученной дозы облучения. Данную ошибку можно минимизировать по определению повреждений хромосомы-2, т.к. наши исследования показали наименьшую вариабельность отклонения показателей её повреждений между донорами. Более того, результаты наших исследований показали, что отношение между центрическими кольцами и дицентриками в хромосоме-2 может являться реперной точкой для оценки дозы облучения высокими ЛПЭ.
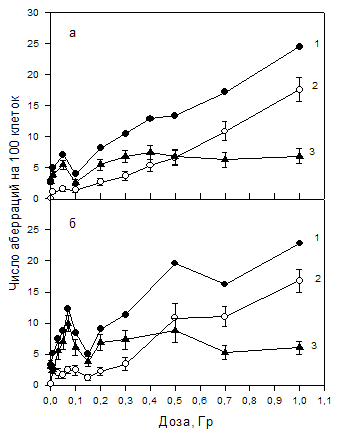 |
| Хромосомные аберрации, индуцированные малыми дозами γ–излучения в лимфоцитах человека двух доноров |
|
|
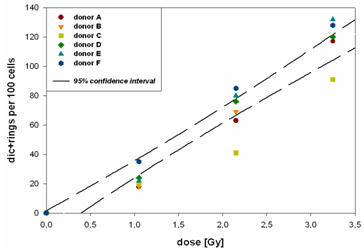 |
| Частота нестабильных хромосомных аберраций в лимфоцитах 6 доноров после облучения ионами 12C 480 МэВ/нуклон |
|
|
-
Проводится сравнительное исследование закономерностей индукции мутаций в клетках млекопитающих разными видами излучений, в том числе тяжелыми ионами в широком диапазоне значений ЛПЭ и исследовали цитогенетические характеристики HPRT-мутантных субклонов, выращенных из одиночных клеток. Ранее было показано, что уровень нестабильности в HPRT-мутантных субклонах клеток линии V79 зависит от качества излучения, индуцирующего мутации. Выявлена геномная и хромосомная нестабильность HPRT-мутантов. Показана существенная роль структурных повреждений хромосом в реализации этих процессов. Длительное сохранение нестабильности хромосом у мутантных субклонов, очевидно, может рассматриваться как универсальное явление для всех диплоидных и полиплоидных клеток эукариотов. Для объяснения результатов исследования была предложена «метаболическая гипотеза» хромосомной нестабильности.
- Проводится изучение закономерностей индукции тяжелыми ионами мутаций различной природы у эукариот. С помощью генетических тестерных систем у дрожжей Saccharomyces cerevisiae в отличие от клеток млекопитающих возможно тестировать как очень мелкие, так и очень крупные изменения молекул ДНК, а именно, замены пар оснований, сдвиг рамки считывания, рекомбинацию, делеции, потерю хромосом. Продолжаются также исследования по изучению генетического контроля регуляции репарации, checkpoint и сигнальных путей, обеспечивающих восстановление клетками как эндогенных, так и экзогенных повреждений ДНК. Предусматривается клонирование и секвенирование новых генов, опосредующих поддержание генетических структур и уровень радиорезистентности клеток.
-
Математическое моделирование индуцированного мутационного процесса у клеток прокариот.
|
|
Postal address:
LRB, JINR, Joliot-Curie 6,
141980 Dubna, Moscow region, Russia
Phone: +7 (49621) 62688
Telefax: +7 (49621) 65948

Copyright © LRB, JINR
|
|
 |


